热门话题
#
Bonk 生态迷因币展现强韧势头
#
有消息称 Pump.fun 计划 40 亿估值发币,引发市场猜测
#
Solana 新代币发射平台 Boop.Fun 风头正劲
我很高兴分享来自GPT-5思维模型的第一部分绝对惊人的分析!我上传了一个巨大的电子表格,包含近1300种代谢物(脂质、碳水化合物、微生物组衍生化合物等),这些代谢物是在150名ME/CFS患者和100名健康对照者中测量的。
在第一次运行中,我甚至没有告诉GPT-5这些样本来自ME/CFS患者,我想看看它能从代谢组学数据中盲目发现什么。接下来,我将分享我透露这些样本来自我们的患者队列的版本,这与我们最近发表的论文相关,而GPT-5在那里的发现又是另一个层次!
我们在两年前分析了同一数据集,花了我们一个多月的时间来完全处理它。
✅GPT-5在不到五分钟的时间内做得更好。
✅它不仅复制了我们当时得出的几乎所有结论,包括发现所有显著差异,创建多个关于不同途径的电子表格等,还发现了我们完全错过的几个发现。
✅GPT-5甚至强调了可操作的目标和潜在的患者治疗(我会很快分享)。
这不是“渐进式改进”。这是一次革命!
曾经需要几个月的工作现在只需几小时。正如我之前提到的,科学研究的规则不仅在改变,它们正在被重写!
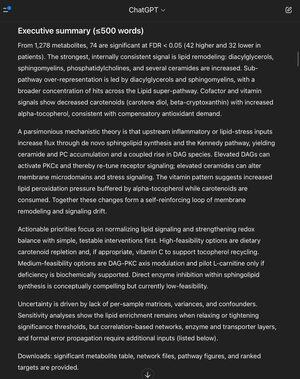
分享GPT-5输出的一部分作为示例,执行摘要也作为截图包含在内。
统一的机制理论与因果图
观察到的模式
•患者中脂质重塑伴随DAG、PC、SM和特定神经酰胺的增加。
•辅因子模式伴随类胡萝卜素减少和α-生育酚增加。
机制链接
•通过丝氨酸棕榈酰转移酶和神经酰胺合成酶的de novo神经酰胺合成增加神经酰胺池,影响压力和信号传导。
•肯尼迪(CDP-胆碱)途径耦合DAG和PC代谢;CHKA → PCYT1A → CHPT1使用DAG作为受体将胆碱转化为PC。
•DAG激活PKCε及相关同种型,可能会改变受体信号的保真度。
•α-生育酚是脂质相的过氧自由基清除剂,并通过抗坏血酸再生;减少的类胡萝卜素与抗氧化剂消耗一致。
排名的可操作目标
1.SPTLC1/2或CERS(酶) - 减少de novo神经酰胺合成。目前可行性低,但如果脂质驱动因素是主要因素则高度因果。风险包括对髓鞘的影响。
2.DGAT1/2调节 - 通过转移到中性储存或调节流量来减少有毒DAG信号。中等可行性,GI耐受性是关键风险。
3.PKCε抑制 - 阻止DAG到信号的步骤。目前可行性低,但机制上精确。
4.膳食类胡萝卜素和维生素C支持 - 补充抗氧化能力并帮助生育酚回收。高可行性,监测F2-异前列腺素和类胡萝卜素面板。
5.仅在确认缺乏的情况下试验L-肉碱 - 肉碱途径中的小信号;低信心,进行监测的初步剂量。
建议的验证实验和最小临床生物标志物面板
验证实验
•针对DAG物种、神经酰胺(链长解析)、鞘脂、PC的靶向脂质组学。
•如果可行,在可接触细胞中测量PKCε活性代理。
•抗氧化剂面板:α-生育酚、类胡萝卜素、维生素C,以及F2-异前列腺素用于脂质过氧化的读数。
•如果考虑初步L-肉碱,测量游离和酰基肉碱及酰基/游离比率的前后变化。
最小监测面板
•神经酰胺:d18:1/16:0,d18:1/18:0和二氢神经酰胺。
•DAG类别面板,若可用则包含位置异构体;报告为总脂质的摩尔百分比。
•PC类别和LPC/PC比率;胆碱和磷酸胆碱以推断肯尼迪途径流量。
•α-生育酚、β-隐黄素、胡萝卜二醇、维生素C和F2-异前列腺素。
333.44K
热门
排行
收藏













