热门话题
#
Bonk 生态迷因币展现强韧势头
#
有消息称 Pump.fun 计划 40 亿估值发币,引发市场猜测
#
Solana 新代币发射平台 Boop.Fun 风头正劲
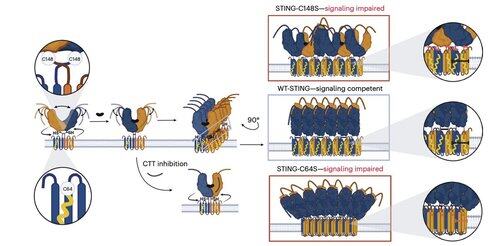
核心研究员 @li_lingyin 在 @NatChemBio 上发表的新论文探讨了为什么人类 STING 抑制剂的疗效有限,尽管在小鼠模型中表现出强大的活性。
这项研究由 @xujun_cao 和 @rjchan426 领导,发现 STING 上常见的靶点并不是人类信号传导所必需的,并确定了一种替代的调控机制。

论文链接:
Li及其同事表明,C91棕榈酰化是包括H-151在内的几种抑制剂的靶点,但对人类STING信号传导并不是必需的。
这有助于解释为什么一些抑制剂在小鼠细胞中阻断STING,但在人体免疫细胞中却没有。
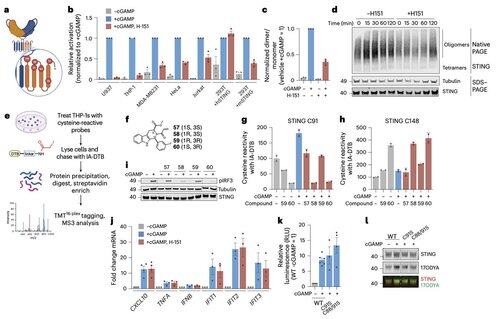
相反,李的团队发现,C64,一个保守的、基底棕榈酰化的半胱氨酸,对于人类STING的激活至关重要。
C64防止STING过早组装成无效的寡聚体,并作为激活前的一个关键检查点。
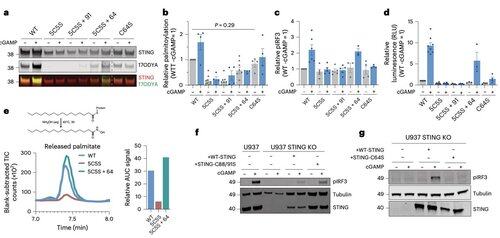
C64和C91的棕榈酰化调节C148的二硫键结合,从而稳定STING寡聚体。
这种二硫键的形成是必要的,但如果发生得太早,会将STING锁定在不活跃状态。
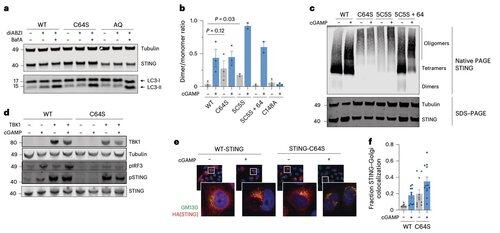
为了超越依赖于上下文的修饰限制,Li的团队专注于寡聚体化界面本身。
这导致发现了一种最小的8个氨基酸肽,它结合了一个特定的、表面暴露的口袋,并阻止了STING的激活。
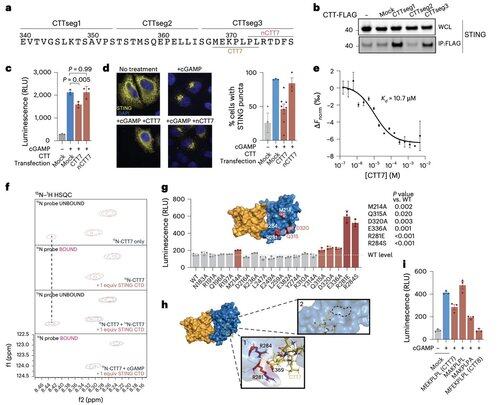
该界面定义了人类STING上一个先前未被识别的、可药物接触的位点,并为设计在不同背景下有效的抑制剂提供了一个有前景的方向。这为未来在自身免疫和炎症方面的治疗开发奠定了基础。
了解更多:
6.18K
热门
排行
收藏













