Tópicos em alta
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.
O novo artigo do investigador principal @li_lingyin em @NatChemBio investiga por que os inibidores de STING humanos mostraram eficácia limitada, apesar da forte atividade em modelos de camundongos.
O estudo, liderado por @xujun_cao e @rjchan426, descobriu que o local comumente visado no STING não é necessário para a sinalização humana e identifica um mecanismo regulatório alternativo.

Link para o artigo:
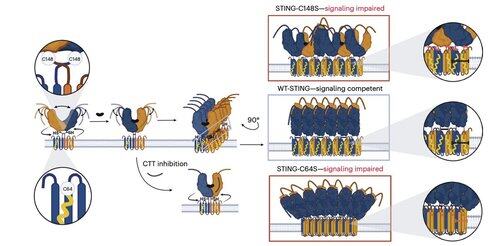
Li e seus colegas mostram que a palmitoilação C91, alvo de vários compostos inibidores, incluindo o H-151, é dispensável para a sinalização STING humana.
Isso ajuda a explicar por que alguns inibidores bloqueiam o STING em células de camundongos, mas não em células imunológicas humanas.
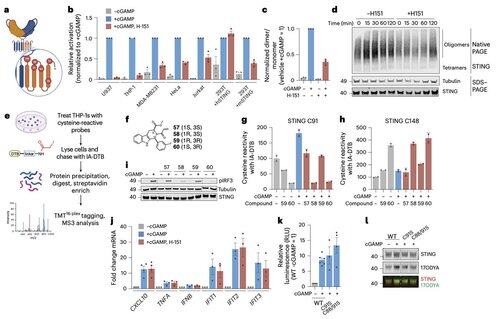
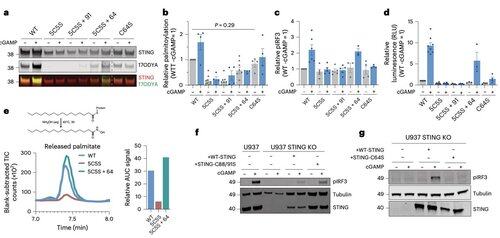
Em vez disso, a equipe de Li descobriu que o C64, uma cisteína conservada e basalmente palmitoilada, é essencial para a ativação do STING humano.
O C64 evita a montagem prematura de STING em oligômeros não produtivos e serve como um ponto de verificação chave antes da ativação.
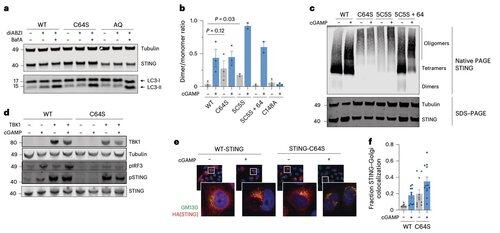
A palmitoilação em C64 e C91 regula a ligação dissulfeto em C148, que estabiliza os oligômeros STEM.
Essa formação de dissulfeto é necessária, mas se ocorrer muito cedo, ela bloqueia o STING em um estado inativo.
Para ir além das limitações das modificações dependentes do contexto, a equipe de Li se concentrou na própria interface de oligomerização.
Isso levou à descoberta de um peptídeo mínimo de 8 aminoácidos que se liga a uma bolsa definida e exposta à superfície e bloqueia a ativação do STING.
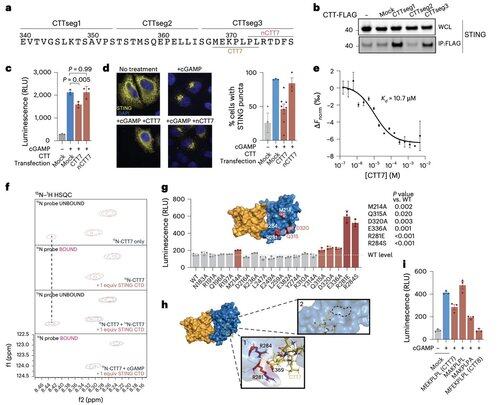
Essa interface define um local acessível a medicamentos anteriormente não reconhecido no STING humano e oferece uma direção promissora para o projeto de inibidores que sejam eficazes em todos os contextos. Isso prepara o terreno para o futuro desenvolvimento terapêutico em autoimunidade e inflamação.
Saiba Mais:
6,18K
Melhores
Classificação
Favoritos













