Tendencias del momento
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.
El nuevo artículo del Investigador Principal @li_lingyin en @NatChemBio investiga por qué los inhibidores de STING en humanos han mostrado una eficacia limitada, a pesar de la fuerte actividad en modelos de ratón.
El estudio, liderado por @xujun_cao y @rjchan426, encuentra que el sitio comúnmente objetivo en STING no es necesario para la señalización humana, e identifica un mecanismo regulador alternativo.

Enlace al artículo:
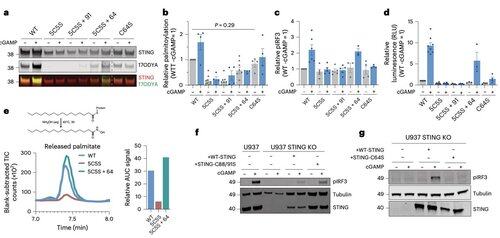
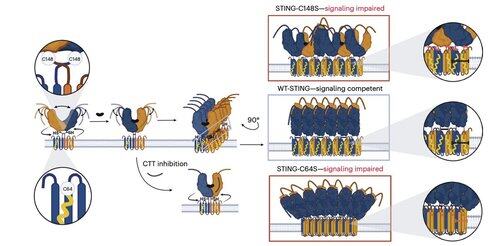
Li y sus colegas muestran que la palmitoilación de C91, el objetivo de varios compuestos inhibidores, incluido H-151, es prescindible para la señalización de STING en humanos.
Esto ayuda a explicar por qué algunos inhibidores bloquean STING en células de ratón pero no en células inmunitarias humanas.
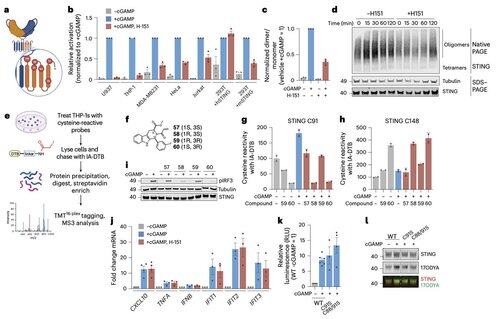
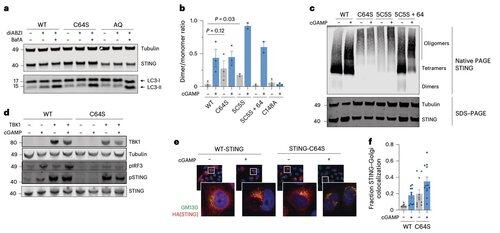
En cambio, el equipo de Li descubre que C64, un cisteína conservada y palmitoilada basalmente, es esencial para la activación de STING en humanos.
C64 previene la ensamblaje prematuro de STING en oligómeros no productivos y sirve como un punto de control clave antes de la activación.
La palmitoilación en C64 y C91 regula el enlace disulfuro en C148, lo que estabiliza los oligómeros de STING.
Esta formación de disulfuro es necesaria, pero si ocurre demasiado pronto, bloquea a STING en un estado inactivo.
Para superar las limitaciones de las modificaciones dependientes del contexto, el equipo de Li se centró en la interfaz de oligomerización en sí.
Esto llevó al descubrimiento de un péptido mínimo de 8 aminoácidos que se une a un bolsillo definido y expuesto en la superficie y bloquea la activación de STING.
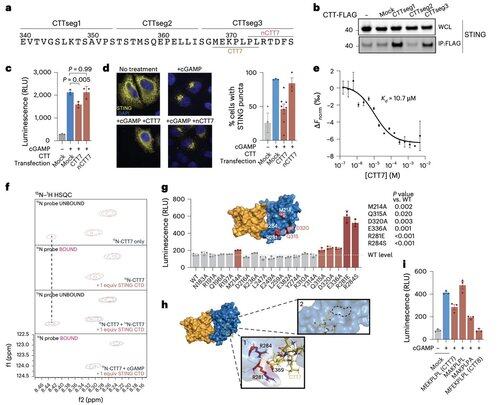
Esta interfaz define un sitio accesible a fármacos en STING humano que no había sido reconocido previamente y ofrece una dirección prometedora para diseñar inhibidores que sean efectivos en diferentes contextos. Esto sienta las bases para el desarrollo terapéutico futuro en autoinmunidad e inflamación.
Aprende más:
6,25K
Parte superior
Clasificación
Favoritos













