Popularne tematy
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.
Nowa praca głównego badacza @li_lingyin w @NatChemBio bada, dlaczego inhibitory STING u ludzi wykazują ograniczoną skuteczność, mimo silnej aktywności w modelach mysich.
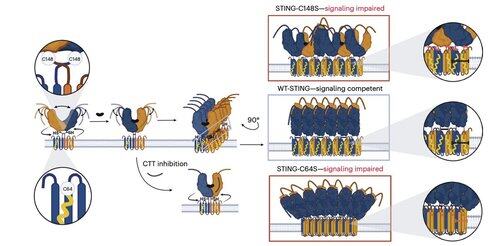
Badanie, prowadzone przez @xujun_cao i @rjchan426, wykazuje, że powszechnie celowany obszar na STING nie jest wymagany do sygnalizacji u ludzi i identyfikuje alternatywny mechanizm regulacyjny.

Link do artykułu:
Li i jej koledzy pokazują, że palmitoilacja C91, będąca celem kilku związków inhibitorowych, w tym H-151, jest zbędna dla sygnalizacji STING u ludzi.
To pomaga wyjaśnić, dlaczego niektóre inhibitory blokują STING w komórkach myszy, ale nie w ludzkich komórkach odpornościowych.
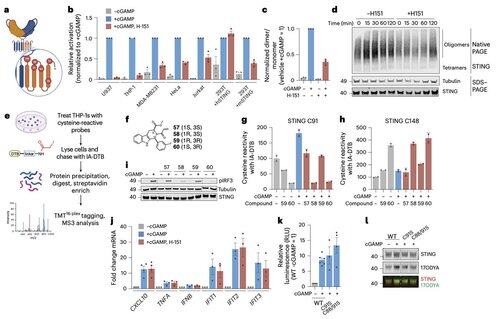
Zamiast tego zespół Li odkrywa, że C64, konserwowana i bazalnie palmitylowana cysteina, jest niezbędna do aktywacji ludzkiego STING.
C64 zapobiega przedwczesnemu łączeniu się STING w nieproduktywne oligomery i pełni rolę kluczowego punktu kontrolnego przed aktywacją.
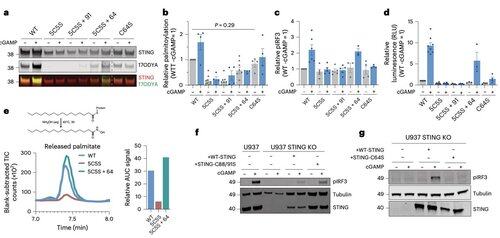
Palmitylacja w pozycji C64 i C91 reguluje tworzenie mostków disulfidowych w pozycji C148, co stabilizuje oligomery STING.
Tworzenie tych mostków disulfidowych jest konieczne, ale jeśli nastąpi zbyt wcześnie, blokuje STING w nieaktywnym stanie.
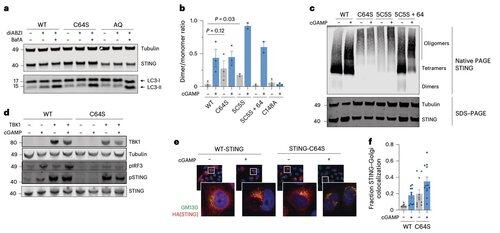
Aby wyjść poza ograniczenia modyfikacji zależnych od kontekstu, zespół Li skupił się na interfejsie oligomeryzacji.
Doprowadziło to do odkrycia minimalnego peptydu składającego się z 8 aminokwasów, który wiąże się z określoną, eksponowaną powierzchnią kieszonką i blokuje aktywację STING.
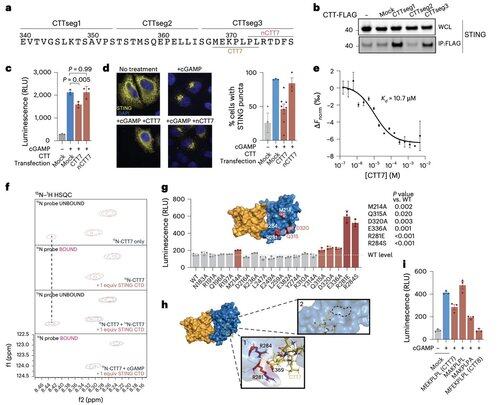
Ten interfejs definiuje wcześniej nieuznawane, dostępne dla leków miejsce na ludzkim STING i oferuje obiecujący kierunek dla projektowania inhibitorów, które są skuteczne w różnych kontekstach. To stwarza podstawy dla przyszłego rozwoju terapeutycznego w autoimmunologii i zapaleniu.
Dowiedz się więcej:
6,18K
Najlepsze
Ranking
Ulubione













