Argomenti di tendenza
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.
Il nuovo articolo del Core Investigator @li_lingyin su @NatChemBio indaga perché gli inibitori STING umani hanno mostrato un'efficacia limitata, nonostante una forte attività nei modelli murini.
Lo studio, guidato da @xujun_cao e @rjchan426, scopre che il sito comunemente mirato su STING non è necessario per la segnalazione umana e identifica un meccanismo regolatorio alternativo.

Link all'articolo:
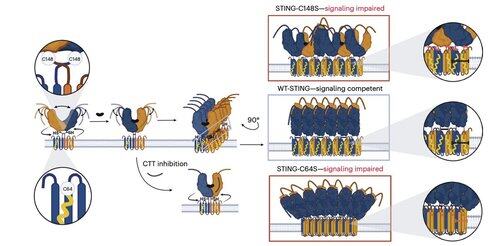
Li e i suoi colleghi dimostrano che la palmitoilazione C91, obiettivo di diversi composti inibitori tra cui H-151, è superflua per il segnale STING umano.
Questo aiuta a spiegare perché alcuni inibitori bloccano STING nelle cellule murine ma non nelle cellule immunitarie umane.
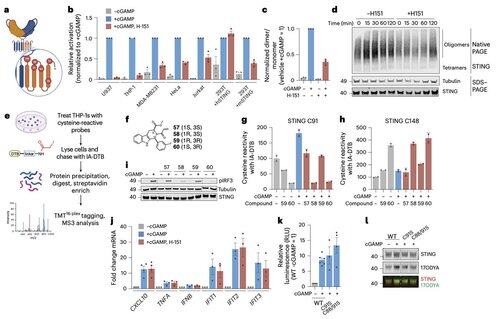
Invece, il team di Li scopre che C64, una cisteina conservata e palmitoilata basale, è essenziale per l'attivazione dello STING umano.
C64 previene l'assemblaggio prematuro dello STING in oligomeri non produttivi e funge da punto di controllo chiave prima dell'attivazione.
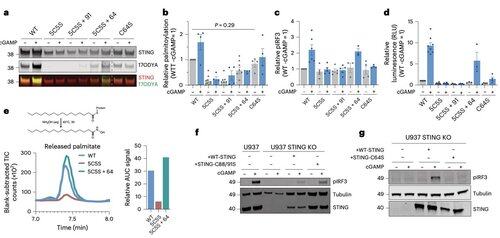
La palmitoilazione in C64 e C91 regola il legame disolfuro in C148, che stabilizza gli oligomeri di STING.
Questa formazione di disolfuro è necessaria, ma se avviene troppo presto, blocca STING in uno stato inattivo.
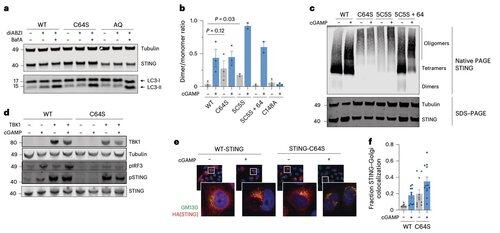
Per superare le limitazioni delle modifiche dipendenti dal contesto, il team di Li si è concentrato sull'interfaccia di oligomerizzazione stessa.
Questo ha portato alla scoperta di un peptide minimo di 8 aminoacidi che si lega a una tasca definita e esposta sulla superficie e blocca l'attivazione di STING.
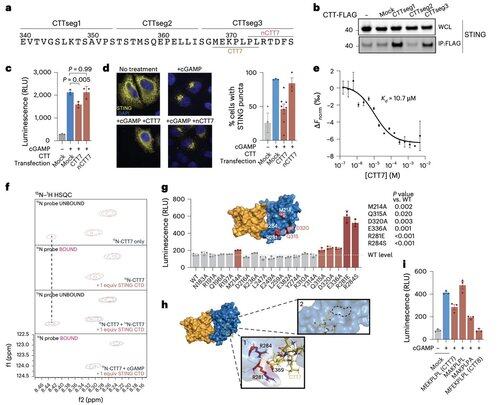
Questa interfaccia definisce un sito precedentemente non riconosciuto, accessibile ai farmaci, sulla STING umana e offre una direzione promettente per la progettazione di inibitori efficaci in diversi contesti. Questo prepara il terreno per lo sviluppo terapeutico futuro nell'autoimmunità e nell'infiammazione.
Ulteriori informazioni:
6,17K
Principali
Ranking
Preferiti













