Populære emner
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.
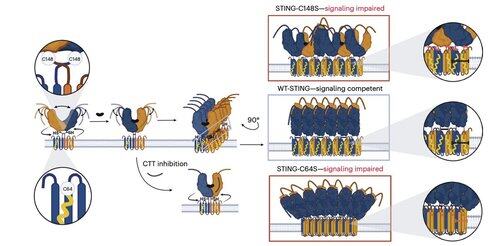
Core Investigator @li_lingyin nye artikkel i @NatChemBio undersøker hvorfor humane STING-hemmere har vist begrenset effekt, til tross for sterk aktivitet i musemodeller.
Studien, ledet av @xujun_cao og @rjchan426, finner at det vanlige stedet på STING ikke er nødvendig for menneskelig signalering, og identifiserer en alternativ reguleringsmekanisme.

Lenke til artikkelen:
Li og hennes kolleger viser at C91-palmitoylering, målet for flere inhibitorforbindelser inkludert H-151, er uunnværlig for human STING-signalering.
Dette bidrar til å forklare hvorfor noen hemmere blokkerer STING i museceller, men ikke i humane immunceller.
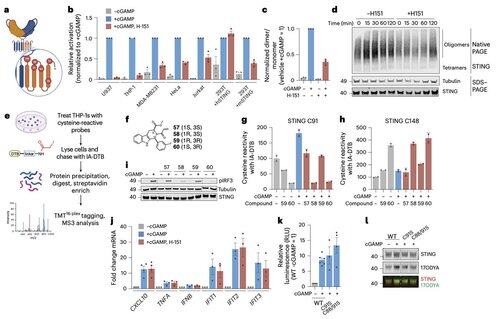
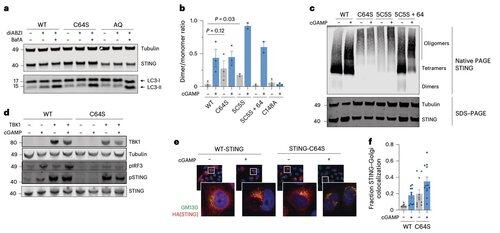
I stedet finner Lis team at C64, et konservert og basalt palmitoylert cystein, er avgjørende for menneskelig STING-aktivering.
C64 forhindrer for tidlig montering av STING i ikke-produktive oligomerer og fungerer som et viktig sjekkpunkt før aktivering.
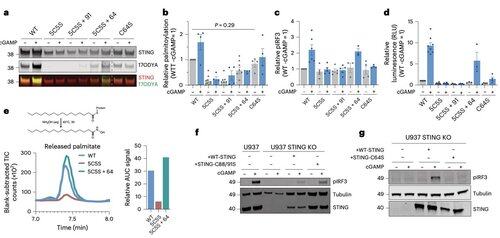
Palmitoylering ved C64 og C91 regulerer disulfidbinding ved C148, noe som stabiliserer STING-oligomerer.
Denne disulfiddannelsen er nødvendig, men hvis den oppstår for tidlig, låser den STING til en inaktiv tilstand.
For å komme forbi begrensningene til kontekstavhengige modifikasjoner, fokuserte Lis team på selve oligomeriseringsgrensesnittet.
Dette førte til oppdagelsen av et minimalt 8-aminosyrepeptid som binder en definert, overflateeksponert lomme og blokkerer STING-aktivering.
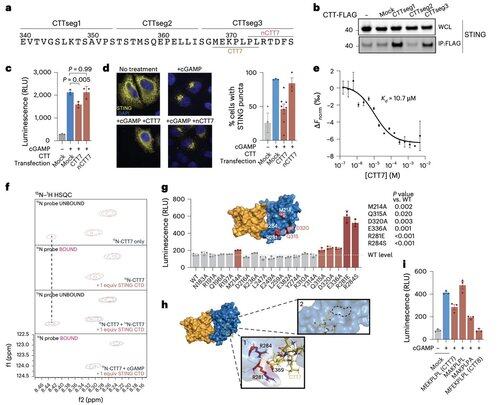
Dette grensesnittet definerer et tidligere ukjent, medikamenttilgjengelig sted på human STING og tilbyr en lovende retning for å designe hemmere som er effektive på tvers av kontekster. Dette setter scenen for fremtidig terapeutisk utvikling innen autoimmunitet og betennelse.
Få mer informasjon:
6,17K
Topp
Rangering
Favoritter













