Populaire onderwerpen
#
Bonk Eco continues to show strength amid $USELESS rally
#
Pump.fun to raise $1B token sale, traders speculating on airdrop
#
Boop.Fun leading the way with a new launchpad on Solana.
De nieuwe paper van Core Investigator @li_lingyin in @NatChemBio onderzoekt waarom menselijke STING-remmers beperkte effectiviteit hebben getoond, ondanks sterke activiteit in muismodellen.
De studie, geleid door @xujun_cao en @rjchan426, ontdekt dat de vaak aangetaste plek op STING niet vereist is voor menselijke signalering, en identificeert een alternatief regulerend mechanisme.

Link naar paper:
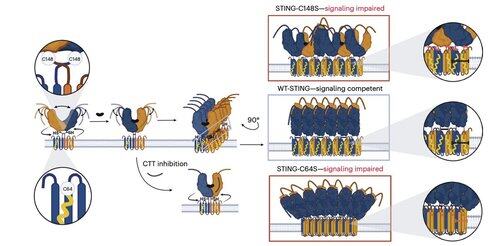
Li en haar collega's tonen aan dat C91 palmitoylatie, het doelwit van verschillende remmende verbindingen waaronder H-151, niet essentieel is voor menselijke STING-signalen.
Dit helpt te verklaren waarom sommige remmers STING blokkeren in muizencellen, maar niet in menselijke immuuncellen.
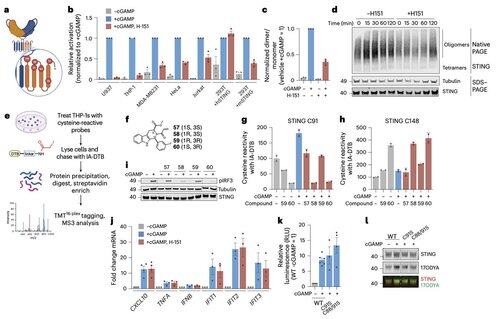
In plaats daarvan ontdekt het team van Li dat C64, een geconserveerde en basaal palmitoyleerde cysteïne, essentieel is voor de activatie van menselijke STING.
C64 voorkomt voortijdige assemblage van STING in niet-productieve oligomeren en fungeert als een belangrijke controlepunt vóór activatie.
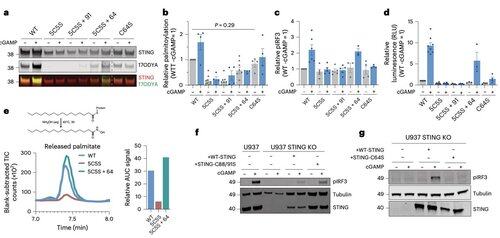
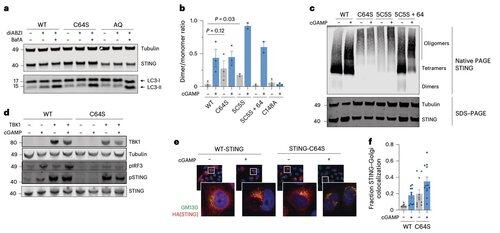
Palmitoylatie op C64 en C91 reguleert de disulfidebinding op C148, wat de STING-oligomeren stabiliseert.
Deze disulfidevorming is noodzakelijk, maar als het te vroeg gebeurt, vergrendelt het STING in een inactieve staat.
Om de beperkingen van contextafhankelijke modificaties te overstijgen, richtte Li's team zich op de oligomerisatie-interface zelf.
Dit leidde tot de ontdekking van een minimale peptide van 8 aminozuren die bindt aan een gedefinieerde, op het oppervlak blootgestelde pocket en de STING-activatie blokkeert.
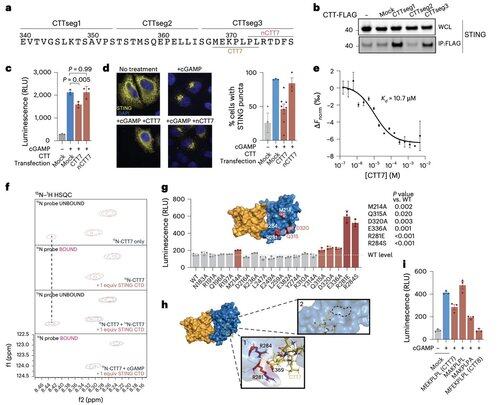
Deze interface definieert een eerder niet herkend, medicijn-toegankelijk gebied op de menselijke STING en biedt een veelbelovende richting voor het ontwerpen van remmers die effectief zijn in verschillende contexten. Dit legt de basis voor toekomstige therapeutische ontwikkeling in auto-immuniteit en ontsteking.
Meer informatie:
6,25K
Boven
Positie
Favorieten













